Работа второго комплекса дыхательной цепи заключается в том что он
Опубликовано: 17.02.2026
Всего цепь переноса электронов (англ. electron transport chain) включает в себя разнообразные белки, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
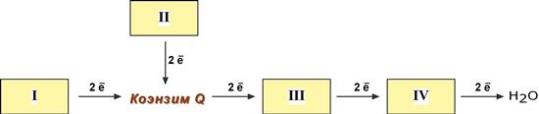
Блок-схема дыхательной цепи
Строение ферментативных комплексов
дыхательной цепи
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа , содержит ФМН, 42 белковых молекулы, из них не менее 6 железосерных белков.
Функция
- Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
- Переносит 4 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
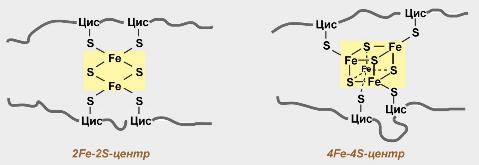
Железосерные белки (FeS-белки) – это белки содержащие атомы железа, которые соединены с атомами серы и с серой остатков цистеина. В результате образуется железо-серный центр.
2 комплекс. ФАД-зависимые дегидрогеназы
Данный комплекс как таковой не существует, его выделение условно. К нему относятся ФАД-зависимые ферменты , расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (β-окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса атомов водорода).
Функция
- Восстановление ФАД в окислительно-восстановительных реакциях.
- Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q ( убихинон ).
3 комплекс. КоQ-цитохром c-оксидоредуктаза
По другому данный комплекс называется цитохром с редуктаза. В его составе имеются молекулы цитохрома b и цитохрома c1, железо-серные белки. Комплекс представляет собой 2 мономера, в каждом из которых насчитывается 11 полипептидных цепей.
Функция
- Принимает электроны от коэнзима Q и передает их на цитохром с.
- Переносит 2 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
4 комплекс. Цитохром с-кислород-оксидоредуктаза
В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза , состоит из 13 субъединиц. В комплексе имеются ионы меди, соединенные с белками комплекса через HS-группы цистеина, и формирующие центры, подобные тем, что имеются в железо-серных белках.
Функция
- Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
- Переносит 4 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
5 комплекс
Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы:
- одна группа формирует субъединицу Fo (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
- другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Механизм работы АТФ-синтазы получил название вращательный катализ.
Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение через АТФ-синтазу приблизительно 3-х ионов Н + , и еще один ион H + используется для транспорта неорганического фосфата в матрикс митохондрии и для антипорта АДФ (в митохондрию) ↔ АТФ (в цитозоль). Таким образом, для получения одной молекулы АТФ из АДФ требуется 4 иона Н + .
Поскольку при прохождении одной пары электронов по всей дыхательной цепи выкачивается 10 ионов Н + , то окисление одного моля НАДН+Н + приведет к образованию 2,5 молей АТФ.
Поэтапное «контролируемое сгорание» достигается путём промежуточного включения дыхательных ферментов, обладающих различным редокс-потенциалом. Редокс-потенциал (окислительно-восстановительный потенциал) определяет направление переноса протонов и электронов ферментами дыхательной цепи (рис.1).
Редокс-потенциал выражается значением электродвижущей силы (в вольтах), которая возникает в растворе между окислителем и восстановителем, присутствующих в концентрации 1,0 моль/л при 25˚ С (при рН=7,0 оба находятся в равновесии с электродом, который может обратимо принимать электроны от восстановителя). При рН=7,0 редокс-потенциал системы Н2 /2Н + +2ē равен – 0,42 v. Знак – означает, что данная редокс-пара легко отдаёт электроны, т.е. играет роль восстановителя, знак + указывает на способность редокс-пары принимать электроны, т.е. играть роль окислителя. Например, редокс-потенциал пары НАДН∙Н + / НАД + равен – 0,32 v, что говорит о высокой её способности отдавать электроны, а окислительно-восстановительная пара ½О2 /Н2О имеет наибольшую положительную величину +0,81 v, т.е. кислород обладает наивысшей способностью принимать электроны.
В процессе окисления АцКоА в ЦТК, восстановленные формы НАДН2 и ФАДН2 поступают в ДЦ, где энергия электронов и протонов трансформируется в энергию макроэргических связей АТФ.
Принципы функционирования ДЦ основаны на 1-ом и 2-ом законах термодинамики.
ДЦ локализуется во внутренней мембране митохондрий и имеет 2 пути введения электронов и протонов или 2 входа; ДЦ образует 4 комплекса.
1 вход: НАД-зависимый (поступают электроны и протоны со всех НАД-зависимых реакций).
2 вход: ФАД-зависимый
Дыхательная цепь – форма реализации биологического окисления.
Тканевое дыхание – это последовательность окислительно-восстанови-тельных реакций, протекающих во внутренней митохондриальной мембране с участием ферментов дыхательной цепи. Дыхательная цепь имеет чёткую структурную организацию, её компоненты формируют дыхательные комплексы, порядок расположения которых зависит от величины их редокс-потенциала (рис.5.1). Количество дыхательных цепей в отдельно взятой митохондрии из клеток разных тканей неодинаково: в печени – 5000, в сердце – около 20 000, следовательно, миокардиоциты отличаются более интенсивным дыханием, чем гепатоциты.
Прежде чем остановиться на характеристике каждого из компонентов дыхательной цепи, познакомимся с субстратами тканевого дыхания.
Субстраты тканевого дыхания подразделяются на 2 группы:
-
НАД-зависимые – субстраты цикла Кребса изоцитрат, α-кетоглутарат и малат. Это также пируват, гидроксибутират и β–гидрокси-ацил
При дегидрировании субстратов НАД-зависимыми дегидрогеназами образуется восстановленная форма НАД (НАДH∙H + ).
НАДH∙H + может образовываться не только в митохондриях, но и в цитозоле клетки при протекании определённых процессов метаболизма. Однако цитоплазматический кофермент не может проникать в митохондрии. Водород восстановленного кофермента должен быть сначала перенесен на субстраты, которые могут проникать в митохондрии. Такими «Н2-переносящими субстратами» являются:
Дигидроксиацетон фосфат → глицерол-3-фосфат
НАДH∙H + затем окисляется 1-м комплексом дыхательной цепи. Рассмотрим работу этого комплекса.
I комплекс цепи тканевого дыхания – НАДH∙H + -убихинон-оксидодуктаза.
Первый комплекс является самым большим в дыхательной цепи (представлен 23-30 субъединицами). Он катализирует перенос водорода от НАДH∙H + на убихинон (рис. 5.1 и рис. 5.3). В его состав входят кофермент ФМН (флавинмононуклеотид) и железосерные белки, содержащие негеминовое железо. Функция этих белков заключается в разделении потока протонов и электронов: электроны переносятся от ФМН∙Н2 к внутренней поверхности внутренней мембраны митохндрий (обращенной к матриксу), а протоны – к внешней поверхности внутренней мембраны и затем высвобождаются в митохондриальный метрикс.
При транспорте протонов и электронов редокс-потенциал первого комплекса снижается на 0,38 v, что вполне достаточно для синтеза АТФ. Однако в самом комплексе АТФ не образуется, а высвобождающаяся в результате работы комплекса энергия аккумулируется (см. ниже образование электро-химического потенциала) и частично рассеивается в виде тепла.
По своему строению ФМН – мононуклеотид, в котором азотистое основание представлено изоаллоксазиновым ядром рибофлавина, а пентозой является рибитол (иными словами, ФМН – это фосфорилированная форма витамина В2).
Функция ФМН заключается в акцепции 2 атомов водорода от НАДH∙H + и передачи их железосерным белкам. Водород (2 электрона и 2 протона) присоединяется к атомам азота изоаллоксазинового кольца, при этом происходит внутримолекулярная перегруппировка двойных связей с образованием промежуточного семихинона – соединения свободнорадикальной природы (на схеме представлено суммарное уравнение реакции, где R – остальная часть молекулы)
II комплекс цепи тканевого дыхания – сукцинат-убихинон-оксидоредуктаза.
Этот комплекс имеет меньшую молекулярную массу и также содержит железосерные белки. Сукцинат-убихинон-оксидоредуктаза катализирует перенос водорода от сукцината на убихинон. В состав комплекса входит кофермент ФАД (флавин-аденин-динуклеотид) и фермент сукцинатдегидрогеназа, который является одновременно ферментом цикла Кребса. Ацил
SКоА, 3-фосфо-глицерат и диоксиацетон фосфат также являются ФАД-зависимыми субстратами тканевого дыхания и с помощью этого кофермента контактируют со вторым комплексом.
Рис. 5.3 Первый комплекс дыхательной цепи
Энергия включения водорода субстратов во II комплекс цепи тканевого дыхания рассеивается в основном в виде тепла, так как на этом участке цепи редокс-потенциал снижается незначительно и этой энергии для синтеза АТФ мало.
Процесс восстановления ФАД протекает аналогично таковому ФМН.
Убихинон (коэнзим Q). Убихинон – небольшая липофильная молекула, по химическому строению представляющая собой бензохинон с длинной боковой цепью (число изопреноидных единиц колеблется от 6 у бактерий до 10 у млекопитающих).
В дыхательной цепи коэнзим Q является своеобразным депо (пулом) водорода, который он получает от различных флавопротеинов. Липофильный характер молекулы убихинона обуславливает его способность свободно перемещаться в липидной фазе митохондриальной мембраны, перехватывая протоны и электроны не только от I и II комплексов дыхательной цепи, но и захватывая из митохондриального матрикса протоны. При этом убихинон восстанавливается с образованием промежуточного свободнорадикального продукта – семихинона .
Восстановленная форма убихинона – убихинол – передаёт протоны и электроны на III комплекс дыхательной цепи.
Между НАД и ФП, b-c, a-a3 имеет место max перепад ОВП. Эти пункты являются местом синтеза АТФ (местом фосфорилирования АДФ).
III комплекс цепи тканевого дыхания – убихинол-цитохром С-оксидоредуктаза. В состав III комплекса входят цитохромы b и с1, относящиеся к группе сложных белков хромопротеинов. Простетическая группа этих белков окрашена (chroma – краска) и близка по химическому строению к гему гемоглобина. Однако в противоположность гемоглобину и оксигемоглобину, в которых железо должно быть только в 2-х валентной форме, железо в цитохромах при работе дыхательной цепи переходит от двух- к трёхвалентному состоянию (и обратно).
Как видно из названия, III комплекс переносит электроны от убихинола на цитохром С. Вначале электроны поступают на окисленную форму цитохрома b (Fe 3+ ), который при этом восстанавливается (Fe 2+ ), затем восстановленный цитохром b передаёт электроны окисленной форме цитохрома с, который также восстанавливается и, в свою очередь, передаёт электроны цитохрому С.
IV комплекс дыхательной цепи – цитохром С-оксидаза. Комплекс назван оксидазой из-за способности непосредственно взаимодействовать с кислородом. У млекопитающих этот крупный (
200 kD) трансмембранный белок состоит из 6-13 субъединиц, из которых некоторые кодируются митохондриальной ДНК. В состав IV комплекса входят 2 хромопротена – цитохром а и цитохром а3. В отличие от других цитохромов, цитохромы а и а3 каждый содержат не только атом железа, но и атом меди. Медь в составе этих цитохромов при транспорте электронов также попеременно переходит в окисленное (Cu 2+ ) и восстановленное (Cu + ) состояние.
Цитохром с-оксидаза катализирует одноэлектронное окисление 4-х восстановленных молекул цитохрома с и при этом одновременно осуществляет полное (4-х электронное) восстановление молекулы кислорода:
4 цитохрома с (Fe 2+ ) + 4 H + + O2 4 цитохрома с (Fe 3+ ) + H2O
Протоны для образования молекул воды поступают из матрикса. Следует заметить, что эта реакция весьма сложна и протекает через промежуточные стадии образования свободных радикалов кислорода.
Окислительно-восстановительный потенциал IV комплекса является самым большим (+0,57 v), его энергии вполне достаточно для синтеза 3-х молекул АТФ, однако большая часть этой энергии используется на «перекачивание» протонов из матрикса митохондрий в межмембранное пространство. В связи с активным транспортом протонов цитохром с-оксидаза получила название «протонного насоса».
Таким образом, тканевое дыхание представляет собой процесс транспорта электронов и протонов от НАД- или ФАД-зависимых субстратов на кислород, а также протонов, поставляемых матриксом митохондрий. При транспорте падает редокс-потенциал, что сопровождается высвобождением заключённой в субстратах тканевого дыхания энергии. Полное восстановление молекулярного кислорода воздуха в дыхательной цепи сопровождается образованием воды.
Окисление субстратов в процессе дыхания можно представить как перенос электронов и протонов (т. е. атомов водорода) от органических веществ на кислород. В этом процессе участвует ряд промежуточных переносчиков, образующих дыхательную цепь.
Дыхательная цепь (электронотранспортная цепь, цепь переноса электронов) - система трансмембранных белков и переносчиков электронов, которые передают электроны от субстратов на кислород. В клетках эукариот дыхательная цепь расположена во внутренней мембране митохондрий в виде 4 ферментных и АТФ-азного комплексов в соответствии с возрастанием окислительно-восстановительного потенциала.
1комплекс -В переносе электронов в толще мембраны митохондрий главную роль выполняет дыхательная цепь. Первый комплекс транспортной цепи принимает на себя молекулы НАД*Н+ (у животных) или НАДФ*Н+ (у растений) с последующим отщеплением четырех протонов водорода. I комплекс также называется НАДН – дегидрогеназой (по названию центрального фермента). В состав дегидрогеназного комплекса входят железосерные белки 3 видов, а также флавинмононуклеотиды (ФМН).Пиридинзависимые дегидрогеназы осуществляют перенос электронов и протонов (водорода) от субстрата. НАДН2, образовавшийся в цикле Кребса, в результате гликолиза и других окислительно-восстановительных процессов, окисляется дегидрогеназой (комплекс I), которая отбирает у него два электрона и протона и переносит их на растворимый в липидах убихинон (во внутреннюю мембрану митохондрий). Во время этого процесса комплекс I перекачивает протоны из матрикса в межмембранное пространство митохондрий.

2 комплекс - Флавинзазисимые дегидрогеназы в качестве кофермента содержат ФАД + или ФМН. К флавинзависимым дегидрогеназам относится сукцинатдегидрогеназа.ФАДН2 окисляется сукцинатдегидрогеназой (комплекс II). При этом процессе протоны не перекачиваются через мембрану, но убихинон получает дополнительные электроны и протоны.
3 комплекс. Восстановленный убихинон (гидрохинон) отдаёт электроны на цитохромный комплекс (комплекс III), а он в свою очередь переносит электроны на два водорастворимых цитохрома с, расположенных на внутренней мембране митохондрии. При этом процессе также переносятся протоны убихинона, которые перекачиваются комплексом.
4 комплекс.Конечным акцептором электронов в дыхательной цепи является кислород. Передачу электронов на кислород осуществляет цитохромоксидаза (комплекс). При этом комплексом IV перекачиваются протоны в межмембранное пространство. Цитохромоксидаза отдаёт электроны на кислород и активирует его. В заключение активированный кислород с двумя протонами образует воду.В итоге при переносе электронов и протонов в дыхательной цепи или цепи переноса электронов образуется протонный потенциал на внутренней мембране митохондрий.В рассмотренной дыхательной цепи конечным акцептором электронов и протонов является кислород. У некоторых микроорганизмов конечным акцептором протонов и электронов выступает нитрат, который восстанавливается до азота или даже до аммиака.
5 комплекс.Синтез АТФ. Общепризнанной теорией синтеза АТФ в ЭТЦ является теория хемиоосмотического сопряжения, выдвинутая П. Митчелом. Сущность ее следующая: процесс окислительного фосфорилирования осуществляется пятым комплексом дыхательной цепи митохондрий — протонной АТФ-синтазой. В процессе транспорта электронов по дыхательной цепи образуется градиент ионов водорода по разные стороны внутренней мембраны митохондрий. Возникший градиент концентрации заставляет протоны проходить через АТФ-синтазу на ту сторону мембраны, где концентрация протонов ниже. На АТФ-синтазе удерживаются АДФ и Фн. Проход протонов через АТФ-синтазу приводит к её конформационным изменениям и соответственно взаимодействию АДФ и Фн. Реакция синтеза такова:
Это наиболее распространенный способ окисления субстрата в клетках, осуществляемый путем дегидрирования. Эффективность этого способа характеризуется высоким коэффициентом полезного действия. Примерно 40% энергии, заключенной в химической связи окисляемых веществ, концентрируется в макроэргических связях АТФ, а остальная энергия рассеивается в виде тепла.
Мембрана, на которой создается электрохимический трансмембранный градиент протонов называется энергизированной. Энергизированная мембрана стремится разрядиться за счет перекачки протонов из межмембранного пространства обратно в матрикс. Этот процесс осуществляется с помощью протонзависимой АТФ-азы.

Синтез АТФ, сопряженный с электронотранспортной цепью

Строение протонзависимой АТФазы
И так, весь комплекс протекающих в митохондриях процессов можно изобразить следующей схемой:

Синтез АТФ из АДФ и фосфорной кислоты за счет энергии, выделяющейся при тканевом дыхании, называется окислительным фосфорилированием.
Процессы окисления и фосфорилирования взаимосвязаны. Их соотношение определяется коэффициентом фосфорилирования Р/О – количество фосфорилированного АДФ в молях на ½ моль кислорода.
Коэффициентом окислительного фосфорилированияназывают отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания.
При окисление молекулы НАДН2 электроны по дыхательной цепи проходят 3 пункта сопряжения, что обеспечивает синтез 3 АТФ при затрате 3 Н3РО4и 3 АДФ на 1 атом кислорода. Соответственно для НАДН2Р/О=3.
При окисление молекулы ФАДН2, электроны по дыхательной цепи проходят только 2 пункта сопряжения, что обеспечивает синтез 2 АТФ при затрате 2 Н3РО4и 2 АДФ на 1 атом кислорода. Соответственно для ФАДН2Р/О=2.
Эти величины Р/О отражают теоретический максимум синтеза АТФ, фактически эта величина меньше из-за затрат на транспорт.
Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. В сутки человек потребляет в среднем 27 моль кислорода. Около 25 моль используется в дыхательной цепи. При среднем значении Р/О=2,5 ежесуточно образуется 125 моль АТФ или 62 кг. В норме субстраты тканевого дыхания и О2находятся в достаточном количестве и не лимитируют окислительное фосфорилирование. Активность окислительного фосфорилирования ограничивает только концентрация АДФ, которая обратно пропорциональна концентрации АТФ.При нагрузке концентрация АТФ снижается, а АДФ увеличивается, что ускоряет дыхание и фосфорилирование. В состоянии покоя количество АТФ увеличивается, а АДФ снижается, что тормозитдыхание и фосфорилирование.
В результате дыхательного контроля скорость синтеза АТФ соответствует потребностям клетки в энергии. Общее содержание АТФ в организме 30—50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40—60 кг АТФ и столько же распадается.
На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела.
Повреждение внутренней мембраны митохондрий или увеличение ее проницаемости под действием разобщителей вызывает исчезновение электрохимического потенциала, разобщение процессов окисления и фосфорилирования, и прекращение синтеза АТФ.
Разобщением дыхания и фосфорилированияназывают явление исчезновения на мембране электрохимического потенциала под действием разобщителей и прекращение синтеза АТФ.
Разобщителямиявляются вещества, которые могут переносить протоны (протонофоры) или другие ионы (ионофоры) через мембрану минуя каналы АТФ-синтетазы. В результате разобщения количество АТФ снижается, АДФ увеличивается, возрастает скорость потребления О2, окисления НАДН2, ФАДН2, а образовавшаяся свободная энергия выделяется в виде теплоты.Как правило, разобщители — липофильные вещества, легко проходящие через мембраны. Например, вещество 2,4-динитрофенол (переносит Н + ), лекарство - дикумарол, метаболит - билирубин, гормон щитовидной железы - тироксин, антибиотики - валиномицин и грамицидин.
Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнеспящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) - термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека.
Дата добавления: 2018-02-28 ; просмотров: 4624 ; Мы поможем в написании вашей работы!
Тканевое дыхание — процесс окисления водорода кислородом до воды ферментами дыхательной цепи. Как указывалось выше, процесс образования воды описывается уравнением:

Дыхательная цепь — последовательность переносчиков электронов на кислород, локализованная во внутренней мембране митохондрий (ВММ). Роль таких переносчиков выполняют:
- активные формы витамина В2 — ФМН и ФАД (присоединяют электроны и протоны);
- атомы железа и меди в составе цитохромов;
- железосерные белки(FeS-белки); цитохромы и железосерные белки переносят только электроны;
- жирорастворимый переносчик электронов и протонов, свободно перемещающийся по мембране, — убихинол (КоQ).
Цель работы дыхательной цепи: провести реакцию окисления водорода кислородом с образованием эндогенной воды.
Принцип работы дыхательной цепи: разделение потоков протонов и электронов, поступающих из матрикса. Электроны передаются на конечный акцептор — кислород; протоны выбрасываются в межмембранное пространство (ММП).
Место того или иного переносчика в дыхательной цепи определяется величиной редокс-потенциала. Все реакции в дыхательной цепи направлены по термодинамической лестнице от компонента с самым отрицательным редокс-потенциалом (НАДH·Н + ) к кислороду, имеющему самый положительный редокс-потенциал.
Редокс-потенциал (Ео) численно равен э. д. с. в вольтах, возникающей между растворами окислителя и восстановителя (концентрации 1М, рН = 7,0, температура 25С). Чем отрицательнее редокс-потенциал системы, тем выше ее способность отдавать электроны (восстановители). Чем положительнее редокс-потенциал, тем выше способность вещества присоединять электроны (окислители).
Перенос электронов по дыхательной цепи осуществляется в следующей последовательности:

Во внутренней митохондриальной мембране переносчики электронов и протонов сгруппированы в 4 белково-липидных комплекса, пересекающих мембрану. Убихинол (КоQ) не входит в состав комплексов; цитохром с, являясь водорастворимым, находится в межмембранном пространстве:

Условные обозначения: ВММ — внутренняя мембрана митохондрий; ММП — межмембранное пространство; ПДГ — пиридинзависимые дегидрогеназы; ФДГ — флавинзависимые дегидрогеназы; ЭХП — электрохимический потенциал; РП — разность потенциалов между восстановителем и окислителем.
Комплексы дыхательной цепи
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН·Н + ; протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью, входящего в состав гемма:
Ш. Убихинол-цитохром с-оксидоредуктаза. Переносит электроны с убихинола на цитохром с. Одновременно за счет энергии, выделившейся при переносе, из матрикса переносятся протоны в межмембранное пространство.
IV. Цитохром с-оксидаза. Переносит электроны с цитохрома с непосредственно на кислород. Цитохромы а и а3, помимо атомов железа, содержат атомы меди, поэтому этот комплекс одновременно осуществляет полное (4-электронное) восстановление молекулы кислорода. Энергия переноса электронов используется на перекачивание в межмембранное пространство протонов.

Как указывалось выше, для синтеза АТФ необходимо затратить около 32 кДж/моль энергии. Для этого достаточной является разность потенциалов между окислителем и восстановителем не менее 0,26 вольта. Чанс, Скулачев установили, что таких участков в дыхательной цепи три. Они соответствуют I, III и IV комплексам и названы пунктами сопряжения или фосфорилирования.
Чтобы понять связь между транспортом электронов по дыхательной цепи и синтезом АТФ, познакомимся с V комплексом внутренней мембраны митохондрий — ферментом, осуществляющим реакцию синтеза АТФ и называемым протонной АТФ-синтазой (см. рис.). Этот ферментативный комплекс состоит из двух частей: Fо
(о – олигомицин), который встроен в мембрану и пронизывает ее насквозь, и F1, Последний по форме напоминает шляпку гриба или дверную ручку и обращен в матрикс митохондрии. В изолированном виде F1 не может синтезировать АТФ, но может проводить ее гидролиз до АДФ и фосфата.
Реакция синтеза АТФ, которую проводит V комплекс, носит название окислительного фосфорилирования и описывается уравнением:
Биохимики долго искали связь — промежуточные макроэргические соединения, которые могли бы служить посредником между процессом тканевого дыхания и окислительным фосфорилированием. Английский биохимик П. Митчелл предположил, что синтез АТФ V комплексом ВММ сопряжен с особым состоянием этой мембраны, и сформулировал хемиоосмотическую теорию окислительного фосфорилирования (Нобелевская премия 1978 г.).
Основные постулаты этой теории:
Дальнейшие исследования (Дж. Уокер, П. Бойер, Нобелевская премия 1997 г.) подтвердили предположения Митчелла. Ими показано, что энергия движения протонов используется на изменения конформации активного центра АТФ-синтазы, что сопровождается синтезом АТФ, а затем ее высвобождением. Образовавшаяся АТФ с помощью транслоказы перемещается в цитозоль; в ответ в матрикс митохондрии поступают АДФ и фосфат. Всего на процесс синтеза, высвобождения и выброса в цитозоль расходуется 4 протона.
При окислении НАД-зависимых субстратов в ММП выбрасывается 10 протонов (см. схему комплексов дыхательной цепи). Следовательно, в таком случае может быть синтезировано 2,5 моль АТФ (10:4), т. е. коэффициент фосфорилирования Р/О = 2,5. При окислении ФАД-зависимых субстратов в ММП выбрасывается 6 протонов в III и IV пунктах сопряжения. В таком случае может быть синтезировано 1,5 моль АТФ (6:4), т. е. коэффициент фосфорилирования Р/О = 1,5.
Теперь можно вернуться к пониманию энергетической функции цикла Кребса (см. предыдущую лекцию). В ЦТК происходят 4 реакции дегидрирования, причем 3 ДГ являются НАД-зависимыми и одна — ФАД-зависимой. За счет окисления водорода 3-х молекул НАДН . Н + в дыхательной цепи синтезируется 7,5 моль АТФ , окисление водорода 1 моль ФАДН2 ведет к синтезу 1,5 моль АТФ. Помимо этого, в ЦТК имеет место одна реакция субстратного фосфорилирования. Таким образом, энергетический выход окисления ацетил-КоА в цикле Кребса равен 10 моль АТФ (7,5 + 1,5 + 1). Этой цифрой мы будем пользоваться в дальнейших расчетах.
Регулируется скорость работы дыхательной цепи энергетическим зарядом клетки,
т. е. соотношением АТФ/АДФ. АДФ является стимулятором дыхательной цепи, АТФ – аллостерическим ингибитором.
Гипоэнергетические состояния возникают в организме вследствие дефицита АТФ в клетках. Причины их следующие:
- алиментарные (голодание, гиповитаминозы РР, В2);
- гипоксические (нарушения доставки О2 в клетки);
- митохондриальные (действие ингибиторов и разобщителей).
Среди последних различают, во-первых, ингибиторы дыхательной цепи. Это яды, которые блокируют перенос электронов через I, II, III, IV комплексы. Ротенон и барбитураты блокируют I комплекс, малонат — II, антимицин А – III, цианиды, угарный газ блокируют перенос электронов на кислород, осуществляемый IV комплексом дыхательной цепи.

Во-вторых, ингибиторы окислительного фосфорилирования (олигомицин), закрывающие протонный канал V комплекса.
В-третьих, разобщители окислительного фосфорилирования. Это вещества, которые подавляют окислительное фосфорилирование, не влияя при этом на процесс переноса электронов дыхательной цепью. Механизм действия разобщителей сводится к тому, что, являясь липофильными веществами, они обладают способностью связывать протоны и переносить их в матрикс, минуя протонный канал Н + АТФ-синтазы. Выделяющаяся при переносе электронов энергия рассеивается в виде тепла. Различают:
- разобщители естественные (продукты перекисного окисления липидов, жирные кислоты с длинной цепью, белки термогенины буровой жировой ткани, большие дозы йодсодержащих гормонов щитовидной железы);
- разобщители искусственные (динитрофенол, производные витамина К, некоторые антибиотики).
Пути утилизации кислорода клеткой
Большая часть кислорода, потребляемого клеткой (около 80 %), используется, как указано, в митохондриях с участием цитохромоксидазы. Это так называемый оксидазный путь. При этом происходит полное восстановление кислорода, причем субстрат не реагирует с кислородом непосредственно. Данный путь дает клетке энергию в виде АТФ. Помимо цитохромоксидазы существуют другие оксидазы (ФМН и ФАД-зависимые), которые катализируют реакции окисления веществ с образованием перекиси водорода
Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω-окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы (гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ + , реже НАД + или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа.
Примерная схема монооксигеназной цепи выглядит следующим образом:

Смысл такого процесса заключается в том, что ксенобиотики, которые обычно гидрофобны, гидроксилируясь, становятся более гидрофильными, что способствует их обезвреживанию и выведению из организма с желчью или мочой. С участием микросомных систем осуществляется также биосинтез стероидов, желчных кислот, витамина Д3.
С появлением в атмосфере кислорода, а он появился тогда, когда возникли фотосинтезирующие организмы, стало возможным более эффективно использовать энергию, т. е. возник механизм окислительного фосфорилирования. Но, с другой стороны, вместе с этим кислород принес и новую опасность. При неполном восстановлении молекулы кислорода образуются высокоактивные формы (свободные радикалы), которые могут повреждать белки, нуклеиновые кислоты, липиды и способны даже убить живую клетку. Активные формы кислорода или свободные радикалы образуются в качестве промежуточных продуктов в ходе микросомного окисления, при работе дыхательной цепи, при воздействии ионизирующего излучения, при самопроизвольном окислении ряда веществ (гемоглобин). Свободные радикалы — молекулы, содержащие неспаренные электроны, агрессивные молекулы, которые атакуют другие молекулы с целью отнять у них электрон. К ним относятся: супероксидный радикал (О2 – ), перекисный радикал (О2 2– ), гидроперекисный радикал (НО 2– ), пероксид водорода (Н2О2), гидроксильный радикал (НО – ).
Свободные радикалы стимулируют разрывы в молекулах нуклеиновых кислот, нарушают функции белков, ведут к деполимеризации протеогликанов соединительной ткани, повреждают ненасыщенные жирные кислоты клеточных мембран, запуская, тем самым, механизм перекисного окисления липидов (ПОЛ). Вместе с тем свободные радикалы кислорода играют и положительную роль, так как участвуют в осуществлении фагоцитами и
Т-лимфоцитами их защитной функции.
Повышенное образование в организме свободных радикалов кислорода ведет к «окислительному стрессу», который может привести к повреждению мембран и гибели клетки. Поэтому в организме существует антиоксидантная защита от свободных радикалов.
Различают неферментативную и ферментативную защиту клеток. Важнейшим компонентом неферментативной защиты является витамин Е (токоферол), витамин размножения.
Являясь жирорастворимым витамином, он всасывается вместе с липидами, поступает в лимфатическую систему и кровяное русло, а оттуда — в ткани. Токоферол защищает ненасыщенные жирные кислоты клеточных мембран от перекисного окисления, предохраняет от окисления SH-группы мембранных белков, защищает от окисления двойные связи в молекулах каротинов и витамина А. Токоферол (совместно с витамином С) способствует включению селена в состав активного центра глутатионпероксидазы — важнейшего фермента антиоксидантной защиты клеток. Он контролирует синтез гема, цитохромов, стабилизирует биологические мембраны.
Ферментативная защита клеток от свободных радикалов (антиоксидантная защита) осуществляется с помощью следующих ферментов:
Дыхательной цепи является частью энергетического метаболизма большинства живых существ . С одной стороны, термин дыхательной цепи обозначает собой метаболический путь , а именно цепь биохимических окислительно - восстановительных реакций , которые имеют место один за другим , что живые существа используют для получения энергии, а с другой стороны , также полноту из белковых комплексов участвует в метаболическом пути .
Дыхательная цепь представляет собой частный случай цепи переноса электронов и вместе с хемиосмосом образует процесс окислительного фосфорилирования .
Электроны , поставляемые с NADH , FMNH 2 и FADH 2 передаются на окислителем в ряде окислительно - восстановительных процессов . Так что - особенно эукариот - экзэргоническая реакция водорода (Н 2 ) и кислород (1/2 O 2 ) для воды разделяются на отдельные шаги. Вместо потенциально взрывоопасного выделения тепла высвободившаяся энергия используется для синтеза универсальной «энергетической валюты» клетки , АТФ , из АДФ и фосфата ( окислительное фосфорилирование ). Водород и переносчики электронов НАДН и ФАДН 2, связанные электроны, и связанный с ними водород возникают в результате окисления внешних доноров электронов, например - посредством цикла Кребса - разложения жирных кислот и гликолиза .
У эукариот дыхательная цепь расположена во внутренней мембране митохондрий , у прокариот - в клеточной мембране . Есть также другие доноры электронов, помимо жиров и сахаров, и другие акцепторы электронов, кроме кислорода.
содержание
Дыхательная цепь как цепь переноса электронов
Цепи переноса электронов состоят из ряда последовательно соединенных окислительно-восстановительных молекул, способных принимать или высвобождать электроны. По этой цепочке электроны переходят с более высоких уровней энергии на более низкие, они падают вниз, так сказать, ступенчато, в результате чего отдельные окислительно-восстановительные молекулы имеют все более низкий уровень энергии. У эукариот ферментные комплексы с I по IV и водородные или электронные переносчики убихинон (кофермент Q) и цитохром c , которые встроены во внутреннюю митохондриальную мембрану, участвуют в цепочке реакции . Белки, участвующие в цепи переноса электронов (комплексы I - IV), и переносчики электронов убихинон и цитохром с образуют (сложную) окислительно-восстановительную систему .
Электронный транспорт связан с захватом и высвобождением протонов. Благодаря пространственной организации этих процессов или посредством конформационных изменений в структуре белка, вызванных потоком электронов , протоны (H + ) «транспортируются» (реальный или как чистый эффект). Это создает «электрохимический протонный градиент » (состоящий из разницы в концентрации протонов и отрицательного мембранного потенциала внутри митохондрий, создаваемого удалением положительно заряженных протонов). Энергия этого «электрохимического протонного градиента» ( протонной движущей силы , «PMF») используется с помощью АТФ - синтазы через обратной диффузии протонов в внутренней митохондриальной мембраны , в соответствии с общепринятой теперь хемиосмотической теории из Питера Д. Митчелла , АТФ из АДФ и неорганических. Синтезировать фосфат (в редких случаях также фруктозу). Это фосфорилирование называется фосфорилированием дыхательной цепи или окислительным фосфорилированием (сокращение: Oxphos ) из-за связи с дыхательной цепью .
Функции комплексов дыхательной цепи

В дополнении к его наружной мембране, митохондрия также содержит внутреннюю мембрану . Пространство между этими двумя мембранами называется межмембранным пространством (перимитохондриальным пространством).
Три из четырех комплексов дыхательной цепи каждый полностью охватывают внутреннюю митохондриальную мембрану (интегрально), тогда как комплекс II заканчивается «слепым» (периферическим). Разница в концентрации протонов возникает между межмембранным пространством и внутренней частью ( матрицей ) митохондрии, которая затем используется в АТФ-синтазе для синтеза АТФ.
Комплекс I.
НАДН: убихинон оксидоредуктаза или НАДН дегидрогеназа . Этот огромный ферментный комплекс (940 кДа ) восстанавливается под действием НАДН , особенно из цикла лимонной кислоты , убихинона (UQ или Q) вместо убигидрохинона, а также убихинола ( дан UQH 2 или QH 2 ). Комплекс состоит из двух частей, которые вместе создают его характерную L-образную форму. Флавинсодержащие нуклеотиды ( FMN ) и центры железо-сера необходимы в качестве простетических групп в единице, чтобы катализировать окислительно-восстановительную реакцию. Из-за переноса электронов, связанного с окислительно-восстановительными реакциями, 3–4 протона на окисленный НАДН перекачиваются в межмембранное пространство. Предполагается, что связывание с транспортом протонов происходит за счет конформационного изменения фермента.
Комплекс II
Сукцинат: убихинон оксидоредуктаза или сукцинатдегидрогеназа . Комплекс II - это фермент сукцинатдегидрогеназа из цикла лимонной кислоты. Во время реакции в цикле лимонной кислоты сукцинат окисляется до фумарата . ФАД - это простетическая группа фермента. Он передает свои электроны в комплексе II убихинону, который восстанавливается до убигидрохинона. Комплекс II также содержит центры железо-сера, такие как комплекс I; однако протоны в межмембранное пространство не закачиваются.
Комплекс III
Убигидрохинон (убихинол): цитохром с оксидоредуктаза или цитохром с редуктаза . В комплексе III Q-цикл способствует возникновению разности концентраций протонов за счет асимметричного поглощения и высвобождения протонов. Во время окисления убихинола (QH 2 ) до убихинона (Q) одна молекула цитохрома c восстанавливается за один цикл на каждый электрон, высвобождаемый (из убихинола), и два протона высвобождаются в межмембранное пространство. Второй электрон восстанавливает другой убихинон в другом месте связывания на митохондриальном матриксе, сначала до свободного радикала убисемихинона (QH), затем до QH 2 , в результате чего два протона абсорбируются из матрицы.
После двух полупериодов четыре протона на молекулу убихинола высвобождаются в межмембранное пространство, два протона удаляются из митохондриального матрикса и два цитохрома с восстанавливаются. В комплексе III происходит переключение с двухэлектронного переносчика (убихинола) на одноэлектронный переносчик (цитохром с ).
Комплекс IV
Цитохром с : О 2 оксидоредуктаза или цитохром с оксидаза . В комплексе IV цитохром с окисляется, а кислород восстанавливается до воды. Выделяемая энергия используется для протонов из матричного пространства в насосе межмембранного пространства .
В комплексе IV цитохром с окисляется, и в комплекс передается электрон. После последовательного переноса четырех электронов (e - ) связанная молекула кислорода может быть уменьшена до двух молекул воды (H 2 O). Необходимые для этого четыре протона (H + ) выводятся из матрицы. Энергия, выделяющаяся при восстановлении кислорода до воды , используется ферментом для перекачки еще четырех протонов на молекулу кислорода из матрицы через внутреннюю митохондриальную мембрану в межмембранное пространство. Это происходит за счет изменений пространственной структуры: в конформации белок имеет высокое сродство к H + и, следовательно, принимает протон. В противоположной конформации наблюдается низкое сродство, и протон высвобождается за пределами мембраны.
Цитохром с оксидаза представляет собой трансмембранный белок с двумя молекулами гема а (гем а и гем а 3 ) в качестве простетических групп и двумя медными центрами (Cu A и Cu B ) в качестве кофакторов . Фермент несет ответственность за почти все потребление кислорода (образование воды из кислорода и водорода в дыхательной цепи) все дышащий кислород организмов.
Ингибиторы дыхательной цепи

Был идентифицирован ряд ингибиторов, которые подавляют цепь переноса электронов в разных точках:
- Ротенон и амобарбитал (Амитал) ингибируют комплекс I (НАДН-оксидазу). Однако, поскольку перенос электронов от FADH2 к комплексу II не изменяется, окислительное фосфорилирование все еще может иметь место.
- Малонат и ряд фунгицидов (SDHI) ингибируют комплекс II (сукцинатдегидрогеназу).
- Антибиотик антимицин А ингибирует комплекс III (цитохром с редуктазу); блокирует перенос электронов от цитохрома b к цитохрому c1 ; компоненты дыхательной цепи перед местом действия антимицина А в комплексе III остаются восстановленными, все позади остаются окисленными. Это подавляет потребление кислорода в комплексе IV и синтез АТФ в комплексе V. Фунгициды из класса стробилуринов также ингибируют комплекс III в точке Q o .
- Цианиды , азиды и окись углерода ингибируют комплекс IV (цитохром с оксидазу); эти молекулы блокируют сайт связывания кислорода . В результате это приводит к накоплению электронов, в результате чего компоненты дыхательной цепи полностью восстанавливаются и дыхательная цепь останавливается. Отравление цианидом приводит к тому, что вены становятся красными, потому что кислород из гемоглобина в артериолах не может диффундировать в клетки, потому что он там не потребляется. Так кровь, богатая кислородом, попадает в вены.
- антибиотик олигомицин ингибирует АТФ-синтазу, связываясь с его сеткой (F o часть, o для чувствительного к олигомицину), что означает, что протонный градиент разрушается намного медленнее. В результате поток электронов для поддержания этого градиента значительно уменьшается, а потребление кислорода снижается. Олигомицин также действует как разъединитель. В соответствующей литературе не делается различия между F 0 (ноль) и F o .
- Бигуаниды, такие как лекарство от диабета метформин, предположительно действуют путем ингибирования комплекса I.
Все ранее упомянутые ингибиторы дыхательной цепи приводят к снижению потребления кислорода. Ингибиторы, известные как развязки, ведут себя иначе.
Разъединитель дыхательной цепи
Разъединители ( протонофоры ) снижают потенциал митохондриальной мембраны (протонный градиент). При этом они прерывают связь между окислением и фосфорилированием. В результате транспорт электронов и функционирование комплексов с I по IV происходит полностью, но протонный градиент, создаваемый во время этого процесса, нейтрализуется развязывающим устройством. Это означает, что синтез АТФ невозможен. Поскольку протоны больше не нужно перемещать против электрохимического градиента, стадии окисления в комплексах с I по IV протекают намного быстрее. В то же время это приводит к повышенному потреблению кислорода.
Читайте также:

